
Aperçu du secteur des dispositifs médicaux en 2023 : données et tendances clés
Actualites
Aperçu des certificats et des transitions réglementaires
Encore une fois, Team NB nous offre une excellente vue de 2023, avec une vision claire de la situation des dispositifs médicaux en Europe. En voici un résumé.
1. Aperçu des certificats valides :
- Fin 2023, il y avait 19 430 certificats CE valides, indiquant une tendance constante au cours de la dernière décennie.
- La majorité de ces certificats relèvent toujours de la directive sur les dispositifs médicaux (MDD) à 88 %, les certificats de dispositifs de diagnostic in vitro (IVDD) représentant 10 % et les certificats de la directive sur les dispositifs médicaux implantables actifs (AIMDD) à 2 %.
2. Demandes et certificats MDR et IVDR :
- Il y a eu une croissance significative des demandes et certificats MDR (Medical Device Regulator), avec un total de 14 539 demandes et 4 873 certificats délivrés en 2023.
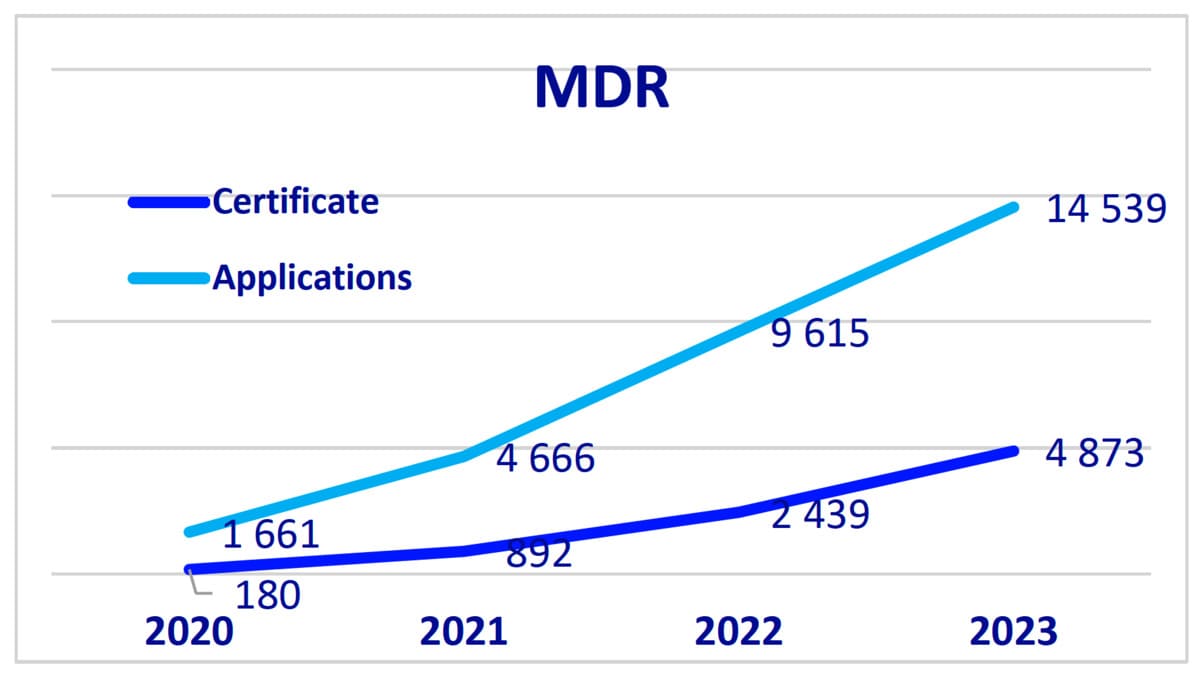
- Pour l'IVDR (In Vitro Diagnostic Medical Device Règlement), 1 565 demandes et 754 certificats ont été délivrés.
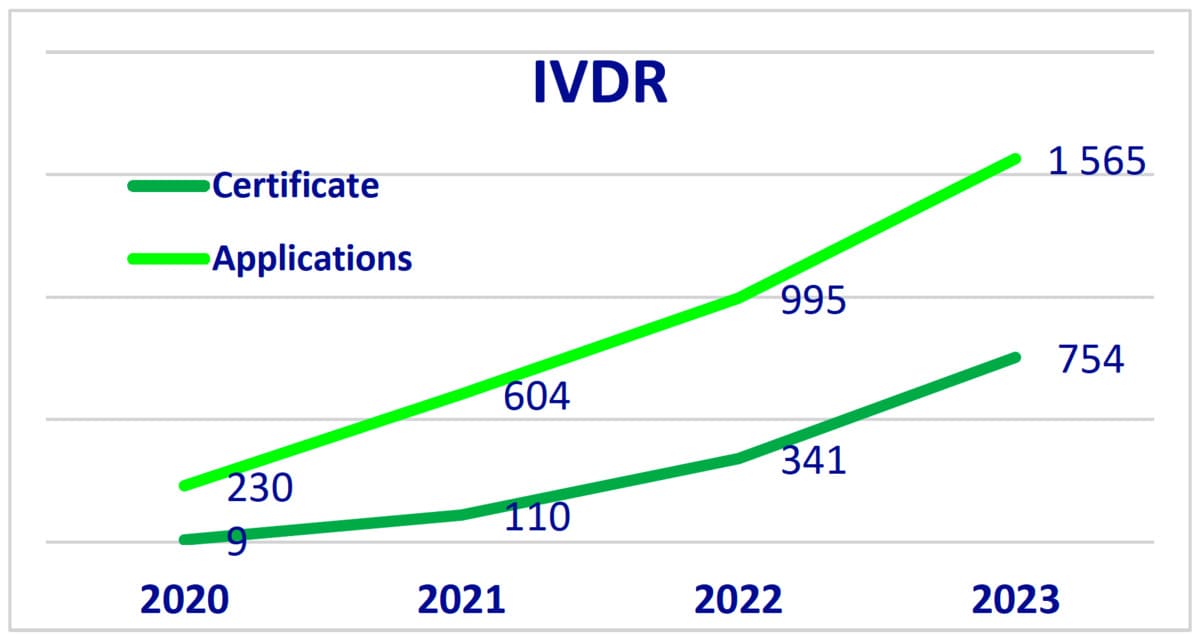
- Les membres de Team-NB, représentant la majorité des organismes notifiés désignés, représentaient 91% des demandes MDR et 96% des demandes IVDR.
3. Répartition des certificats :
- La répartition des certificats montre une évolution notable vers la nouvelle réglementation. Les certificats MDR constituent désormais 24,8% du total, tandis que les certificats IVDR représentent 3,9%.
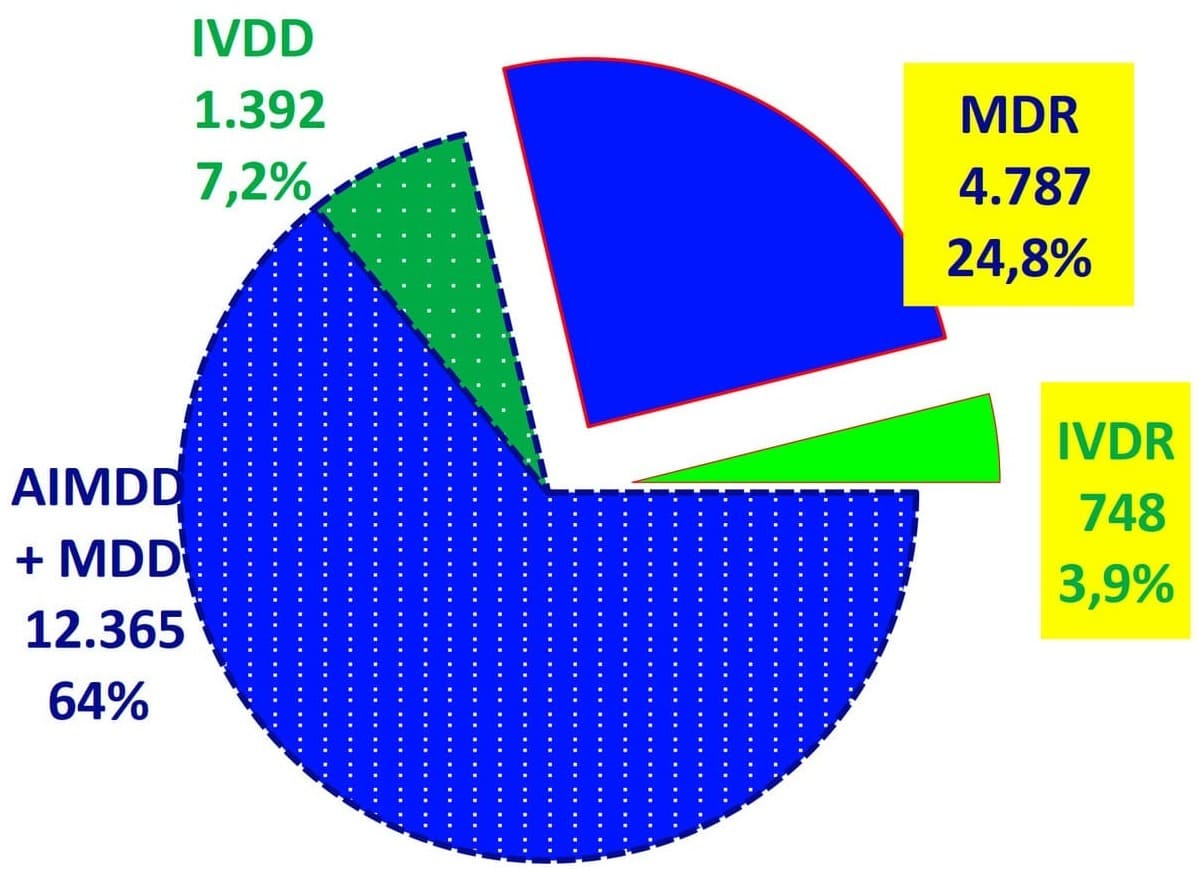
- Cette transition est essentielle à mesure que les fabricants passent des directives aux réglementations, avec un nombre accru de certificats attendus dans le cadre de la nouvelle réglementation en raison d'exigences et de classifications plus détaillées.
Dynamique et défis du marché
1. Taille et répartition des organismes notifiés :
- Les organismes notifiés sont classés en fonction du nombre de certificats délivrés : « grand » (> 1 000 certificats), « moyen » (350 à 1 000 certificats) et « petit » ( <350 certificats). En 2023, 11 % étaient de grande taille, 29 % de taille moyenne et 60 % de petite taille.
- Cette répartition reflète un nombre croissant de petits organismes notifiés, qui a augmenté d'environ 10 % par rapport à l'année précédente.
2.Contrôles d'exhaustivité et documentation technique :
- Le contrôle d'exhaustivité de la documentation technique, essentielle à la conformité réglementaire, a connu des améliorations. En 2023, 87 % des organismes notifiés ont effectué ces contrôles, contre 81 % en 2022 et 79 % en 2021.
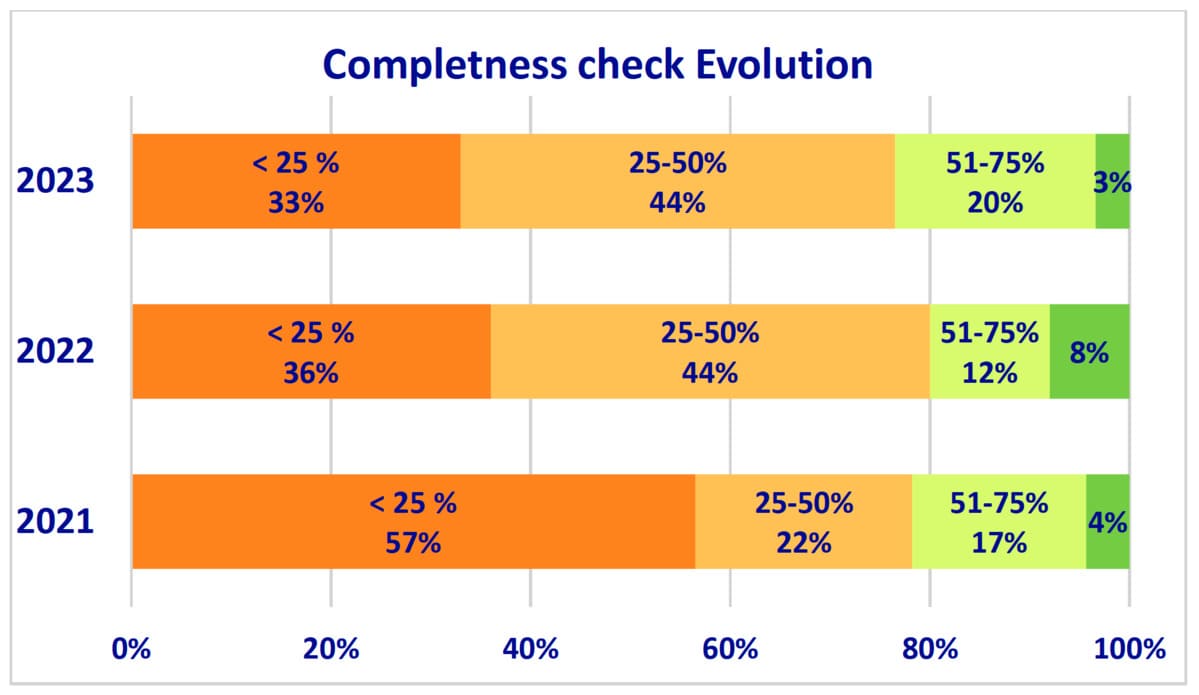
- Malgré ces améliorations, 75 % des soumissions nécessitaient encore des informations supplémentaires pour démarrer l'évaluation.
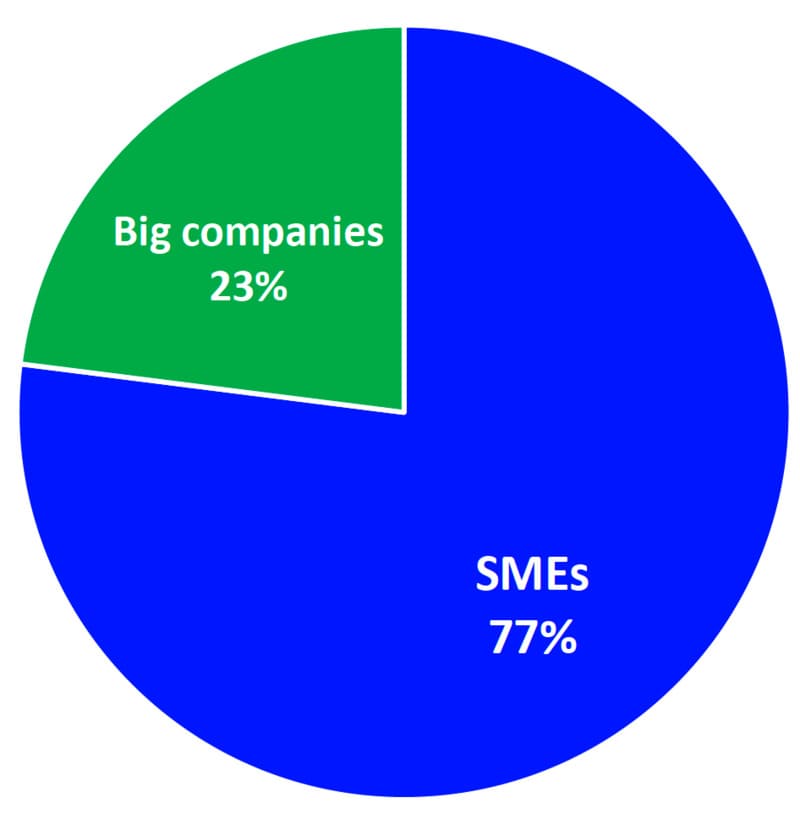
3. Accès des PME :
- Les Petites et Moyennes Entreprises (PME) représentent une part importante des activités des organismes notifiés, constituant 77% de leur clientèle. Cela met en évidence le rôle crucial que jouent les PME dans le secteur des dispositifs médicaux.
Effectif et aperçu opérationnel
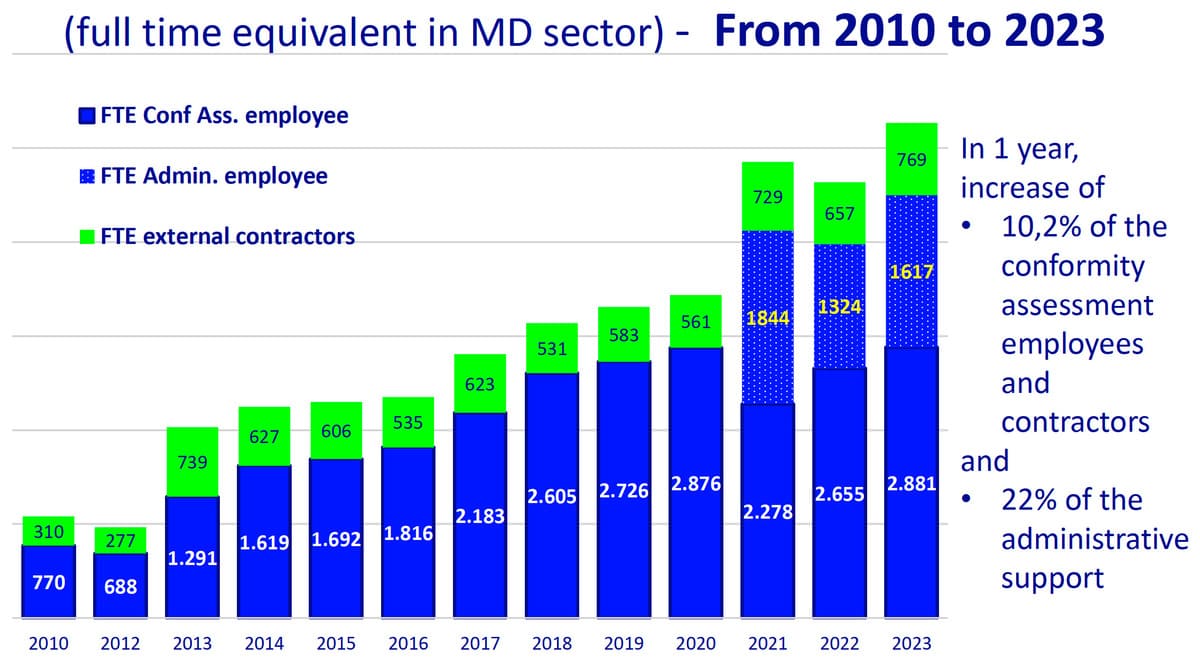
1. Personnel et ressources :
- Le secteur a connu une augmentation du personnel dédié aux évaluations de conformité, avec une augmentation de 10,2 % du nombre d'employés techniques et de sous-traitants en 2023. Le personnel de soutien administratif a également augmenté de 22 %.
- Les organismes notifiés élargissent leurs équipes techniques et administratives pour gérer le volume croissant d'évaluations réglementaires et garantir la conformité au MDR et à l'IVDR.
2. Certifications ISO 13485 et MDSAP :
- Le nombre de certificats ISO 13485 a augmenté pour la quatrième année consécutive, avec 20 682 certificats valides en 2023, soit une augmentation de 6 % par rapport à l'année précédente.
- Les certifications MDSAP (Medical Device Single Audit Program) ont également connu un nombre important, avec 4 748 certificats délivrés.
Conclusion
La transition vers le MDR et l'IVDR est en bonne voie, avec une augmentation significative des demandes et des certificats. Cependant, les fabricants doivent s'assurer que leur documentation technique répond aux exigences strictes pour éviter les retards dans la certification. Notre cabinet de conseil est spécialisé dans l’aide aux fabricants de dispositifs médicaux pour naviguer dans ces paysages réglementaires, en garantissant la conformité et des transitions fluides.
Contactez-nous pour savoir comment nous pouvons répondre à vos besoins réglementaires et rationaliser votre processus de soumission.